学部・研究科・附属病院の歴史

学部・研究科・附属病院の歴史

学部・研究科・附属病院の歴史

学部・研究科・附属病院の歴史
がんの発生・進展・転移の分子メカニズムを明らかにします
近年、がん化の原因となる遺伝子が数多く同定され、それらが指令するタンパクは細胞の増殖や生存などを制御するシグナル伝達系に関与することがわかってきました。そしてそのようなタンパクを攻撃する分子標的治療薬や抗体医薬が開発されていますが、それらが適応となる症例は決して多くなく、薬剤耐性の獲得や副作用などからも、さらなる治療標的の同定や薬剤耐性を生じにくい治療法の開発が急務となっています。
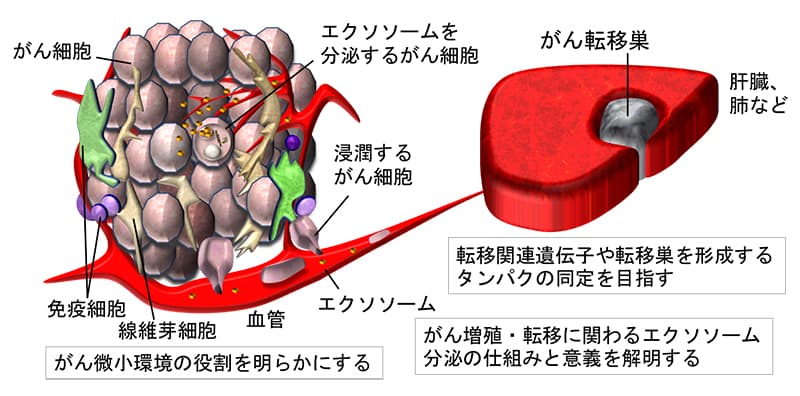
腫瘍制御学分野では、がんの発生から転移に至る悪性化進展について、1)固形がんの浸潤・転移機構、がん悪液質の病態生理(青木・藤下)、2) シグナル分子の制御破綻によるがん進展機構、がんエクソソーム分泌の機構と意義(小根山)を中心に研究を展開して、新機軸の治療法開発を目指しています。
客員教授 ⻘⽊ 正博
客員教授 ⼩根⼭ 千歳
客員准教授 藤下 晃章
老年性認知症最大の原因であるアルツハイマー病の発症機序解明と治療薬の開発、及び老化現象の理解と克服を目指します
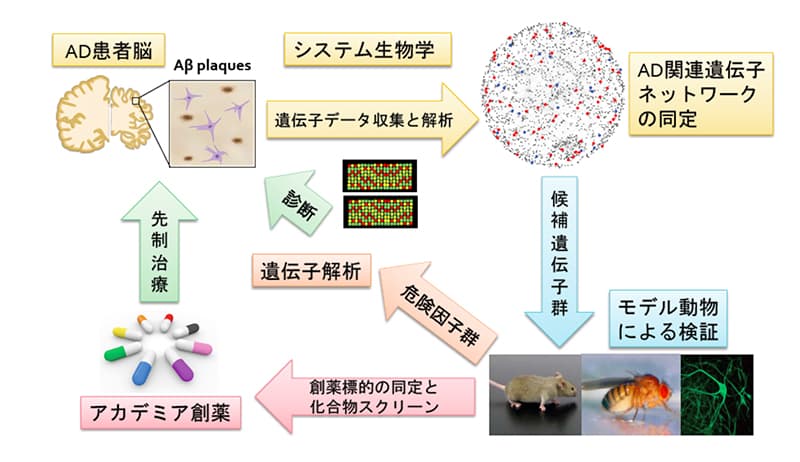
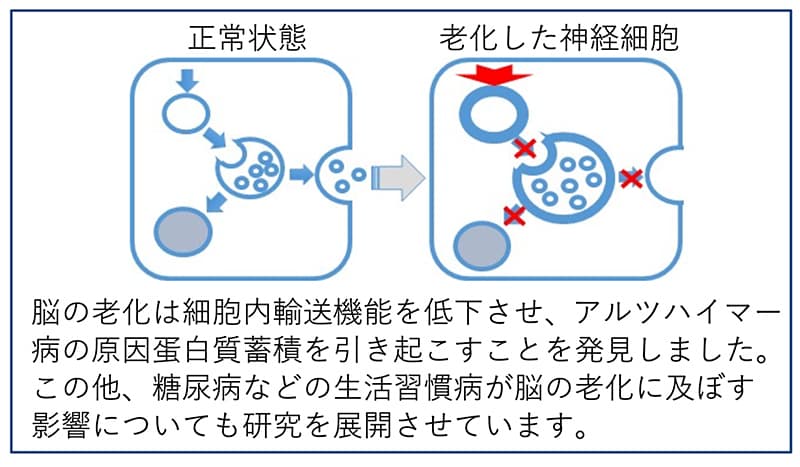
加齢病態制御学分野では、健康長寿社会の構築に貢献するために、老年性認知症、特にアルツハイマー病の病態解明と脳老化メカニズムの研究を行っています。
飯島グループは、関谷准教授、木村准教授と協力し、アルツハイマー病の診断法や予防法の確立、さらに症状の進行を止める治療薬開発を目指し研究を進めています。
関谷グループは、情報解析とショウジョウバエ・マウスモデルによる実験検証から、アルツハイマー病の発症機序の解明を目指した研究を進めています。
木村グループは、ヒトと同じ霊長類であるカニクイザルをモデルとして、脳の老化とは何か、アルツハイマー病の根本を理解するための基礎老化研究を行っています。
客員教授 飯島 浩⼀
客員准教授 ⽊村 展之
客員准教授 関⾕ 倫⼦
統合生物学的手法による
アルツハイマー病発症機序の解明
先端的医薬品と再生医療等製品の迅速な実用化を目指して
新技術を用いた医薬品や再生医療等製品を安心して臨床で活用するには、未知のリスクを把握するとともに製品や工程を最適化するための新たな評価法が必要となります。医薬品質保証学研究室では急速に高機能化が進むドラッグデリバリーシステム(DDS)製剤や次世代の医薬として注目を浴びる再生医療等製品の有効性や安全性について、レギュラトリーサイエンスの観点からガイドライン設定や日本薬局方での収載を視野に評価法を検討し、優れた製品を臨床へ迅速に届けるための研究をしています。例えば吸入剤では肺をモデルとした装置による微粒子サイズ評価法の開発を進めるとともに、品質を設計段階から構築していくための検討をしています。また、再生医療等製品の素材として注目を浴びている ヒトiPS細胞には腫瘍形成能があるため、分化後の最終製品への混入を防止することが必須であり、我々は未分化iPS 細胞の高感度検出法の開発に成功するなど、実用化に向けたレギュラトリーサイエンスを研究しています
客員教授 伊⾖津 健⼀
客員准教授 安⽥ 智
ヒトiPS細胞から作った心筋細胞[高倍率]
筋線維(緑)、心筋細胞の核(赤)](../../../../img/meishidai-history/academics/grad-phar/grad-phar-labo25.jpg) (左)ヒトiPS細胞のコロニー[低倍率]
(左)ヒトiPS細胞のコロニー[低倍率]
(右)ヒトiPS細胞から作った心筋細胞[高倍率]
筋線維(緑)、心筋細胞の核(赤)
動的な生命現象をシステムとして理解する
私達の体を構成する細胞は、細胞外から絶えず様々な入力を感知し、その情報を細胞内のシグナル伝達分子系により処理し、適応的な表現型を出力することで恒常性を維持します。これらのタンパク質の遺伝子に変異が入ったり、タンパク質自体が凝集体を形成したりすることで悪性腫瘍や神経疾患などの疾病の発症につながります。私達の分野では、以下の2点の研究を進めています。青木グループでは、蛍光イメージングによるシグナル伝達系の可視化や光操作を通じて、悪性腫瘍に関連する細胞内シグナル伝達系の動的な振る舞いの理解を目指しています。奥村グループは、分子動力学計算によるタンパク質の立体構造解析を通じて、タンパク質の折りたたみの理解と間違って折りたたまれたことにより発病する病気の原因解明、治療を目指しています。
客員教授 青木 一洋
客員准教授 奥村 久士
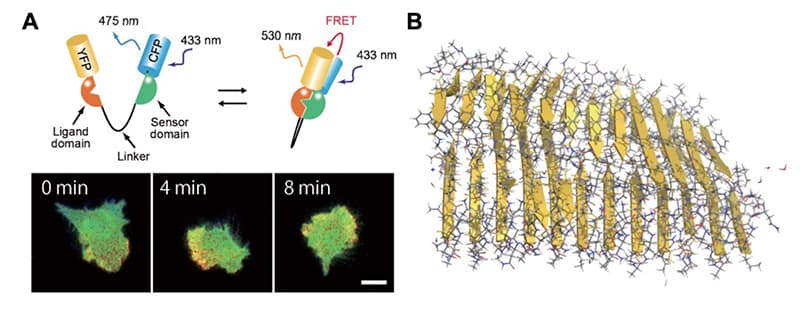 A. FRETバイオセンサーによるシグナル伝達系の可視化。
A. FRETバイオセンサーによるシグナル伝達系の可視化。
B. 分子動力学によるアミロイド線維の凝集。)
最新の科学知識を医薬品・医療機器の審査に活かす
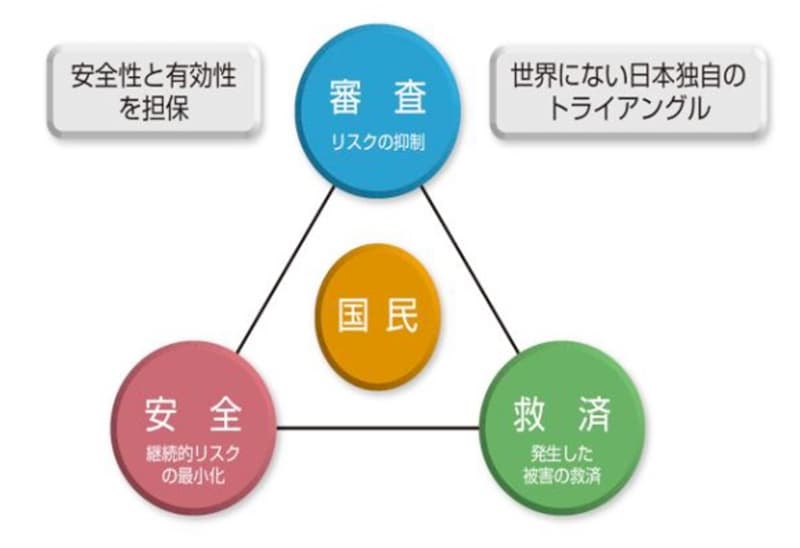
我が国では、新医薬品や新医療機器、再生医療等製品の審査は、PMDA(独立行政法人医薬品医療機器総合機構)において、厚生労働省との密接な連携のもと行われている。PMDAでは、審査業務とともに、健康被害救済業務、安全対策業務を行っており、これら三業務による総合的なリスクマネジメント、いわゆるセーフティトライアングルを通じて、国民の健康・安全の向上に貢献している。いずれの業務もその根幹にあるのはレギュラトリーサイエンスの概念である。
本講座では、医薬品、医療機器等の開発段階から承認審査、市販後の安全対策、救済制度の流れを概説するとともに、併せて最近の動向を紹介する。
客員教授 大澤 智子