病態解析学
スタッフ

青山 峰芳
[教授]

青木 啓将
[講師]

鳥内 皐暉
[助教]
教育・研究
- エリスロポエチンによる脳保護治療
- 動脈硬化症発症の初期バイオマーカーの探索
- ヒトiPS細胞由来神経幹細胞の分化制御
- インフルエンザ脳症におけるグリア機能異常
- 破骨細胞分化機構の解明
- 難治性胃癌の新規治療法の開発
研究概要
1. エリスロポエチンによる脳保護治療(名市大医学部・新生児・小児医学分野との共同研究)
脳室周囲白質軟化症 (PVL) は、在胎34週未満の早産児に特有の疾患で、軽度の虚血により脳室周囲が傷害され、脳性麻痺となる。根本的な治療法はなく、運動機能障害が残る。病態は脳の発達段階の特徴に起因する。
- 脳室周囲白質は、早産児で虚血に陥りやすい
- オリゴデンドロサイト前駆細胞(OPC)の選択的な傷害が起こる
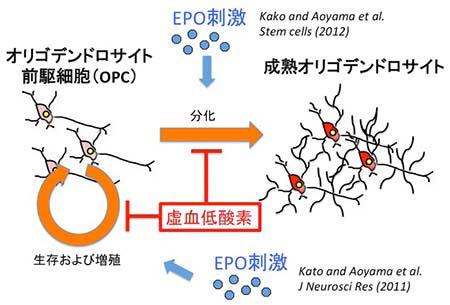
図1 エリスロポエチン (EPO) のオリゴデンドロサイト前駆細胞 (OPC) への効果
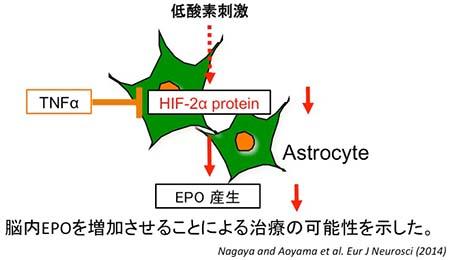
図2 TNFαによる脳内EPO産生抑制
2. 動脈硬化症発症の初期バイオマーカーの探索(名市大医学部・心臓・腎高血圧内科学分野との共同研究)
近年、病態の診断や予防、治療への反応性や効果などの予測を目的とした各種マーカーの開発が注目されており、疾病の予防やオーダーメイド医療への応用が期待されている。低分子ノンコーディングRNAの一種であるmiRNAは、標的の遺伝子やタンパク質の発現を微調整することで発生や形態形成、アポトーシス、細胞増殖、生殖機能等の様々な生物学的機能に関与している。近年、エクソソームのような小胞顆粒に包埋されて体内を循環する、分泌型miRNAが大きな注目を集めている。分泌型miRNAは、がんをはじめとした疾患の病態や進行度合いなどの生理状態によってその発現量や種類が大きく変動することが知られ、血液を利用した低侵襲性の診断用バイオマーカーとして期待されている。しかしながら、動脈硬化発症の指標となる分泌型miRNAの存在はまだ明らかにされていない。
我々はこれまでに、名古屋市立大学病院心臓・腎高血圧内科の外来を受診した、古典的な心血管危険因子 (高血圧、脂質異常症、糖尿病、喫煙) を有する無症候かつ無治療の患者における分泌型miRNAの発現を検討し、特定のmiRNAの発現が有意に変動することを見い出した。我々は、動脈硬化発症初期に特異的なバイオマーカーとなる分泌型miRNAに着目し、動脈硬化の早期発見法の確立ならびに患者個々の症状にあわせたオーダーメイド医療への応用を目指しています。
我々はこれまでに、名古屋市立大学病院心臓・腎高血圧内科の外来を受診した、古典的な心血管危険因子 (高血圧、脂質異常症、糖尿病、喫煙) を有する無症候かつ無治療の患者における分泌型miRNAの発現を検討し、特定のmiRNAの発現が有意に変動することを見い出した。我々は、動脈硬化発症初期に特異的なバイオマーカーとなる分泌型miRNAに着目し、動脈硬化の早期発見法の確立ならびに患者個々の症状にあわせたオーダーメイド医療への応用を目指しています。
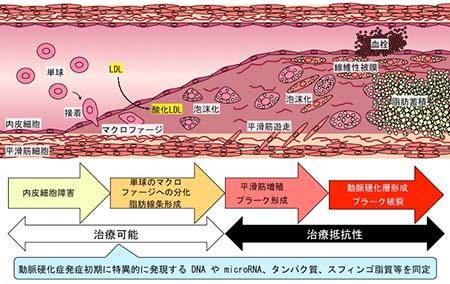
図3 動脈硬化症発症の初期バイオマーカーの探索
動脈硬化の発症は血管内皮機能の障害により始まる。この段階では薬物療法や補充療法、生活習慣改善などにより症状の改善が可能であるが、症状が進展すると平滑筋の増殖やプラーク形成、石灰化へと至り治療抵抗性となるため、より早期の診断と治療開始が必要である。しかしながら、動脈硬化は遺伝的素因に対して種々の環境因子が複雑に関与するため、それぞれの危険因子の寄与度や治療に対する応答は患者により異なる。そのため、個々の患者の症状を正確に評価する方法の開発が必要とされている。
3. インフルエンザ脳症におけるグリア機能異常(名市大医学部・新生児・小児医学分野との共同研究)
インフルエンザ脳症 (IAE) は、インフルエンザウイルス感染発病後の急性中枢神経疾患である。発症機序として、ウイルスの中枢神経への直接侵入ではなく、血中サイトカインの異常増加いわゆる「サイトカインストーム」が考えられている。患者剖検脳でアストロサイトの活性化が認められた。
ジクロフェナック(DCF) は、 小児の感染に伴う発熱に対する解熱鎮痛剤として使用されていた。しかし、インフルエンザ脳症患者に対するDCFの使用が死亡率を上げることが報告され、現在は小児の解熱剤としては使用されていない。我々は、DCFがアストロサイトのNO産生を増加させ、細胞障害性を亢進させることを見いだした。
ジクロフェナック(DCF) は、 小児の感染に伴う発熱に対する解熱鎮痛剤として使用されていた。しかし、インフルエンザ脳症患者に対するDCFの使用が死亡率を上げることが報告され、現在は小児の解熱剤としては使用されていない。我々は、DCFがアストロサイトのNO産生を増加させ、細胞障害性を亢進させることを見いだした。
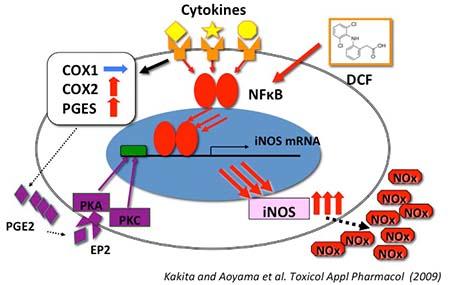
図4 DCFによる細胞障害性亢進機構
4. 難治性胃癌の新規治療法の開発(名市大医学部・ 消化器・代謝内分泌科学分野との共同研究)
Reovirusは、新たな腫瘍溶解性ウイルスとして期待されており、海外では第III相臨床試験が進んでいる。
Trastuzumabは、ヒト癌遺伝子の産物であるHER2タンパクに特異的に結合することで抗腫瘍効果を発揮する。分子標的治療薬として、HER2過剰発現の胃癌で有効性が証明されている。
我々は、ReovirusとTrastuzumab併用のXenograft modelでの効果を検討したところ、併用群において腫瘍縮小効果が認められた。
Trastuzumabは、ヒト癌遺伝子の産物であるHER2タンパクに特異的に結合することで抗腫瘍効果を発揮する。分子標的治療薬として、HER2過剰発現の胃癌で有効性が証明されている。
我々は、ReovirusとTrastuzumab併用のXenograft modelでの効果を検討したところ、併用群において腫瘍縮小効果が認められた。
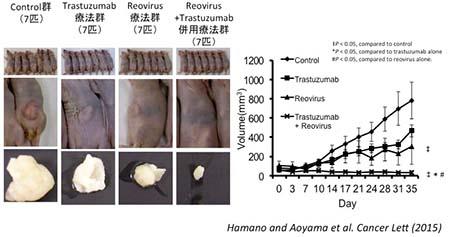
図5 ReovirusとTrastuzumab併用のXenograft modelでの効果
連絡先
〒467-8603
名古屋市瑞穂区田辺通3-1
名古屋市立大学 大学院薬学研究科 医療機能薬学専攻
病態解析学分野
薬学研究科広報委員会
名古屋市瑞穂区田辺通3-1
名古屋市立大学 大学院薬学研究科 医療機能薬学専攻
病態解析学分野
薬学研究科広報委員会

