抗体の地図を描く:NMRで明らかにする抗体のFc領域の構造の秘密〜非標識NMRによる高次構造評価の新戦略、抗体医薬の品質管理に革新〜
本研究は、同日公開されるAnalytical Chemistry誌掲載論文と連携した連続的研究の基盤となる成果であり、応用展開の基礎を提供するものです。
発表のポイント
•ヒト抗体のFc領域におけるメチル基の部位特異的なNMR信号割り当てを達成しました。
•抗体医薬品をそのままの状態で、糖鎖構造やアミノ酸置換に依存する微細な構造変化を検出することが可能になりました。
•抗体や医薬品の品質評価に応用可能な実用的プラットフォームを確立しました。
•抗体医薬品をそのままの状態で、糖鎖構造やアミノ酸置換に依存する微細な構造変化を検出することが可能になりました。
•抗体や医薬品の品質評価に応用可能な実用的プラットフォームを確立しました。
研究の背景
抗体医薬はがんや自己免疫疾患の治療に不可欠であり、世界市場で急速に拡大しています。しかし、その効果や安全性は、抗体の高次構造注1)に強く依存します。製造過程や保存条件によって構造がわずかに変化すると、薬効や副作用に影響を及ぼす可能性があります。従来の評価法(CD、FT-IR、DSCなど)は全体像を示すにとどまり、原子レベルの情報は得られませんでした。NMRは原子レベルの情報を提供できますが、これまでの手法は指紋パターンの比較のみに依存し、構造変化の部位と原因を特定することが困難でした。
研究の成果
自然科学研究機構 生命創成探究センター/分子科学研究所、東京科学大学総合研究院フロンティア材料研究所、名古屋市立大学大学院薬学研究科の研究チームは、ヒトIgG1抗体のFc領域注2)に存在するメチル基を部位特異的に割り当てるNMR解析法を確立しました。この手法により、抗体の構造を座標化し、原子レベルで「地図」として描くことが可能となりました。さらに、糖鎖構造の違いに起因する微細な変化を非標識状態で検出できることを示しました。具体的には、フコースの有無やガラクトース末端構造の差異がスペクトルに反映されることを確認し、これらの特徴が製剤化抗体や市販抗体にも適用可能であることを実証しました。加えて、動的フィルタリング法を用いることで、ヒンジ領域や受容体結合部位における柔軟性を選択的に評価し、抗体の機能に直結する領域の動態を明らかにしました。これらの成果は、抗体医薬の品質評価や設計開発における新たな指標を提供するものです。
成果の意義および今後の展開
本研究で確立した非標識NMRによる抗体構造解析技術は、抗体医薬の品質保証における新たな基盤を提供します。抗体医薬はがんや自己免疫疾患など、生命に直結する治療に広く用いられていますが、その効果と安全性は分子構造の微細な違いに依存します。従来の評価法では、製造ロット間のわずかな構造差異や糖鎖修飾注3) の変化を検出することは困難でした。本研究の成果により、抗体の構造を「地図」として描き、糖鎖の状態や局所的な柔軟性を精密に把握することが可能となります。これにより、バイオシミラーの承認プロセスや製造工程の品質管理が飛躍的に向上し、患者にとってより安全で信頼性の高い医薬品の供給が実現します。また、国際的な規制評価や標準化への貢献が期待され、抗体医薬の開発競争において日本発の技術が世界をリードする可能性を秘めています。
今後は、抗体医薬の品質評価にとどまらず、製剤ストレスや長期保存による構造変化のモニタリング、酸化や脱アミド化などの化学修飾の検出へと応用範囲を広げます。さらに、Fc融合タンパク質や次世代抗体フォーマットへの適用を進め、抗体医薬の多様化に対応する技術基盤を構築します。規制当局との連携を強化し、国際標準化に向けたデータ提供や評価指標の策定を目指すことで、バイオ医薬品の品質管理における新たなグローバルスタンダードを確立します。加えて、動的フィルタリングを活用した機能部位の柔軟性評価を深化させ、抗体設計や改良に資する構造情報を提供することで、創薬研究の加速にも寄与します。
本研究は、2026年2月11日(水曜日)午後10時(日本時間)に国際学術誌「Journal of the American Chemical Society」にオンライン公開されました。
今後は、抗体医薬の品質評価にとどまらず、製剤ストレスや長期保存による構造変化のモニタリング、酸化や脱アミド化などの化学修飾の検出へと応用範囲を広げます。さらに、Fc融合タンパク質や次世代抗体フォーマットへの適用を進め、抗体医薬の多様化に対応する技術基盤を構築します。規制当局との連携を強化し、国際標準化に向けたデータ提供や評価指標の策定を目指すことで、バイオ医薬品の品質管理における新たなグローバルスタンダードを確立します。加えて、動的フィルタリングを活用した機能部位の柔軟性評価を深化させ、抗体設計や改良に資する構造情報を提供することで、創薬研究の加速にも寄与します。
本研究は、2026年2月11日(水曜日)午後10時(日本時間)に国際学術誌「Journal of the American Chemical Society」にオンライン公開されました。
用語説明
注1) 高次構造(HOS):タンパク質の一次構造が折りたたまれ、複雑な立体構造を形成した状態。
注2) Fc領域:抗体の定常領域で、免疫応答に関与する重要な部位。
注3) 糖鎖修飾:タンパク質に付加される翻訳後修飾の一つで、抗体の機能や安定性に影響。
注2) Fc領域:抗体の定常領域で、免疫応答に関与する重要な部位。
注3) 糖鎖修飾:タンパク質に付加される翻訳後修飾の一つで、抗体の機能や安定性に影響。
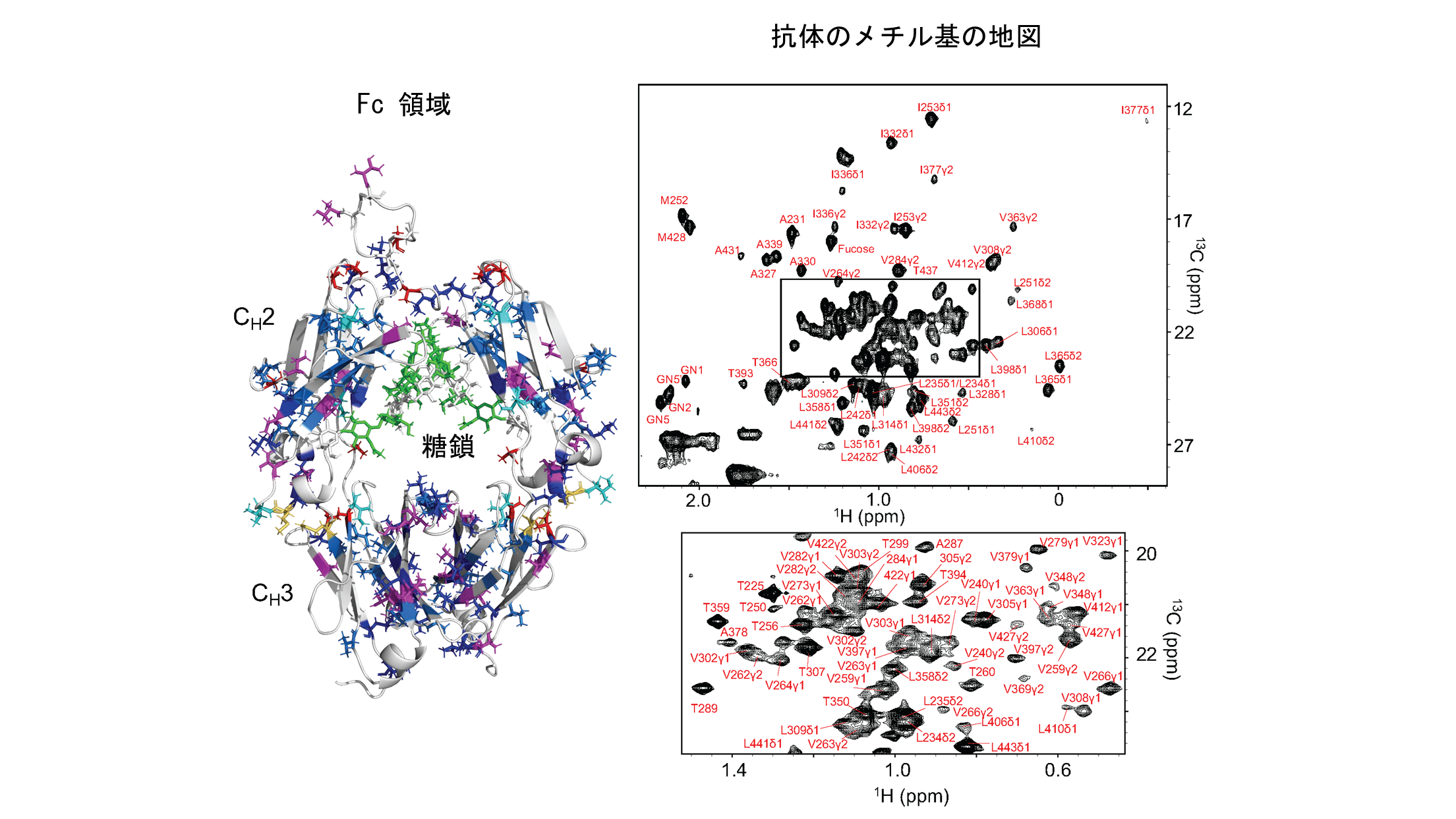
抗体のFc領域に存在するメチル基のNMR信号の地図
左:メチル基を含む残基を3次元モデル上に示している。アミノ酸残基タイプ別に色分けしている。右:抗体のFc領域のNMR信号およびその帰属
論文情報
タイトル:Unlabeled NMR Approach with Site-Specific Methyl Assignments for Structural Evaluation of the IgG1 Fc Region
著者:Saeko Yanaka*, Yuuki Koseki, Yohei Miyanoiri, Toshio Yamazaki, Tsutomu Terauchi, Daichi Kaneko, Yukiko Isono, Kohei Tomita, Sachiko Kondo, Masayoshi Onitsuka, Maho Yagi-Utsumi, Hirokazu Yagi, Akiko Ishii-Watabe, Koichi Kato*(* 責任著者)
掲載誌:Journal of the American Chemical Society
DOI:https://doi.org/10.1021/jacs.5c18997
論文公開日:2026年2月11日(水)午後10時(日本時間)
著者:Saeko Yanaka*, Yuuki Koseki, Yohei Miyanoiri, Toshio Yamazaki, Tsutomu Terauchi, Daichi Kaneko, Yukiko Isono, Kohei Tomita, Sachiko Kondo, Masayoshi Onitsuka, Maho Yagi-Utsumi, Hirokazu Yagi, Akiko Ishii-Watabe, Koichi Kato*(* 責任著者)
掲載誌:Journal of the American Chemical Society
DOI:https://doi.org/10.1021/jacs.5c18997
論文公開日:2026年2月11日(水)午後10時(日本時間)
著者情報
谷中冴子(生命創成探究センター/分子科学研究所、スピン生命科学コア、東京科学大学)、小関悠希(東京科学大学)、宮ノ入洋平(大阪大学蛋白質研究所、生命創成探究センター、スピン生命科学コア)、山崎俊夫(理化学研究所)、寺内勉(大陽日本酸素株式会社)、金子大智(大陽日本酸素株式会社)、磯野裕貴子(生命創成探究センター/分子科学研究所)、富田晃平(名古屋市立大学)、近藤幸子(生命創成探究センター、名古屋市立大学)、鬼塚正義(徳島大学)、矢木真穂(生命創成探究センター/分子科学研究所、スピン生命科学コア、名古屋市立大学)、矢木宏和(生命創成探究センター、名古屋市立大学)、石井明子(国立医薬品食品衛生研究所)、加藤晃一(生命創成探究センター/分子科学研究所、名古屋市立大学)
研究サポート
本研究は、文部科学省科学研究費助成事業(JP23K24018およびJP25H02252谷中冴子、JP19H01017およびJP24H00599加藤晃一)、日本医療研究開発機構(AMED)(JP21ae0121020および JP23ak0101209谷中冴子、JP21ae0121013加藤晃一)、文部科学省共同利用・共同研究システム形成事業~学際領域展開ハブ形成プログラム~(CURE)課題番号JPMXP1323015488(Spin-LプログラムNo. spin24XN014)、生命創成探究センター共同利用研究(24EXC901、25EXC603)、および科学技術振興機構(JST)戦略的創造研究推進事業(CREST)(JPMJCR21E3 加藤晃一)の助成を受けたものです。また、大阪大学蛋白質研究所共同利用・共同研究拠点 NMRCR-16-05, 17-05, 18-05, 19-05, 20-05, 21-05、24-05、25-05文部科学省先端研究設備共用促進事業(コアファシリティ構築支援プログラム)JPMXS0441500024、国際・産学連携インヴァースイノベーション材料創出(DEJI2MA)プロジェクト、およびヒューマングライコームプロジェクトの支援を受けて行われました。
