血流が生体内で再生ニューロンの移動を促進する仕組み解明
研究成果の概要
名古屋市立大学大学院医学研究科 脳神経科学研究所の澤本和延教授(生理学研究所兼任)、荻野 崇特任助教(現:藤田医科大学)、斎藤明里らの研究グループは、生理学研究所、滋賀医科大学、バレンシア大学などの研究者と共同で、成体脳で産生された新生ニューロン(注1)は、血流の多い血管に沿って移動しやすく、その結果、ニューロン再生が血流供給の豊富な場所で生じることを発見しました。
さらに、血流の多い血管では、少ない血管に比べて新生ニューロンの移動が促進されていることを見出し、空腹時に胃で産生される末梢ホルモンのグレリンが、血液から脳へと輸送されて新生ニューロンの移動を促進することを明らかにしました。
本研究は、全身の情報を運び、さらに生活環境によって変動する血流が、脳で局所的に生じるニューロン再生を制御するという全体的調整メカニズムの存在を示唆しています。また、その仕組みをヒトの脳傷害後の治療に応用することで、血流によるニューロン再生促進という新たな医学的アプローチにつながる可能性があります。
さらに、血流の多い血管では、少ない血管に比べて新生ニューロンの移動が促進されていることを見出し、空腹時に胃で産生される末梢ホルモンのグレリンが、血液から脳へと輸送されて新生ニューロンの移動を促進することを明らかにしました。
本研究は、全身の情報を運び、さらに生活環境によって変動する血流が、脳で局所的に生じるニューロン再生を制御するという全体的調整メカニズムの存在を示唆しています。また、その仕組みをヒトの脳傷害後の治療に応用することで、血流によるニューロン再生促進という新たな医学的アプローチにつながる可能性があります。
研究のポイント
・新生ニューロンが血流の多い血管に沿って移動しやすく、結果的に血液供給の豊富な場所で定着しやすいことを明らかにしました。
・血流の多い血管では新生ニューロンの移動速度が大きくなり、血流を阻害することでその移動速度が低下することを見出しました。
・空腹時に血中濃度が増加するグレリンが細胞内のアクチン細胞骨格(注2)収縮を活発にさせることで、新生ニューロンの移動を促進することを発見しました。
・血流の多い血管では新生ニューロンの移動速度が大きくなり、血流を阻害することでその移動速度が低下することを見出しました。
・空腹時に血中濃度が増加するグレリンが細胞内のアクチン細胞骨格(注2)収縮を活発にさせることで、新生ニューロンの移動を促進することを発見しました。
背景
マウスなどの哺乳類では、生後にほとんどの脳領域で新たな神経細胞の産生は止みますが、脳室下帯や海馬など一部の領域では成体でも新しい神経細胞(以下新生ニューロン)が産生され続けています。マウスの脳室下帯で生み出された新生ニューロンは嗅覚情報を制御する嗅球へと移動し、そこで成熟することで神経活動を担うようになります。
嗅球では、古いニューロンが細胞死を起こして失われますが、新生ニューロンがつねに供給されることによって、生理的条件下で「ニューロン再生」が生じています。
これまで、新生ニューロンは脳内を血管に沿って移動することが知られていました。しかし、生きた動物において脳深部を観察することが難しかったことから、血管を流れる血液が新生ニューロンの移動にどのような影響を与えるのかは明らかとなっていませんでした。
本研究では、二光子顕微鏡(注3)という特殊な顕微鏡を用いることによって脳深部を観察することを可能とし、生きたマウスの脳内で新生ニューロンの移動と血流、両方の動態を解析しました。さらに、超解像イメージングによって、細胞内の微細な変化を捉えることで、血中因子グレリンの作用を詳細に検証しました。
嗅球では、古いニューロンが細胞死を起こして失われますが、新生ニューロンがつねに供給されることによって、生理的条件下で「ニューロン再生」が生じています。
これまで、新生ニューロンは脳内を血管に沿って移動することが知られていました。しかし、生きた動物において脳深部を観察することが難しかったことから、血管を流れる血液が新生ニューロンの移動にどのような影響を与えるのかは明らかとなっていませんでした。
本研究では、二光子顕微鏡(注3)という特殊な顕微鏡を用いることによって脳深部を観察することを可能とし、生きたマウスの脳内で新生ニューロンの移動と血流、両方の動態を解析しました。さらに、超解像イメージングによって、細胞内の微細な変化を捉えることで、血中因子グレリンの作用を詳細に検証しました。
研究の成果
本研究では、はじめに未熟な新生ニューロンの移動と血流との関係を調べるために、二光子顕微鏡を用いた生体内の深部イメージングを行いました。その結果、未熟な新生ニューロンは血流の少ない血管に比べて、血流の多い血管の近傍に高頻度で存在しており、そのような血管に沿って移動した結果、血流の豊富な場所で成熟することが明らかとなりました。
血流の多い血管の近傍ほど新生ニューロンの移動速度が大きくなっていることから、血流が新生ニューロンの移動を促進していることが示唆されました。そこで、実際に新生ニューロンの移動が血流に依存するかどうかを調べるために、光血栓形成法(注4)を用いることによって、血管一本のレベルで血流を阻害する実験を行いました。移動中の新生ニューロンが沿っている血管の血流を阻害したところ、新生ニューロンの移動速度が低下したことから(下図A)、新生ニューロン移動が血流に依存していることが明らかとなりました。
以上のことから、血液中に何らかの移動促進因子が含まれている可能性が考えられました。本研究では、過去の報告を踏まえて、空腹時に胃で産生される末梢ホルモンであるグレリンに着目しました。蛍光標識したグレリンを血液中に投与し、脳内への輸送を調べたところ、血液由来グレリンの脳内輸送は血流の多い血管において盛んであることが分かりました。
グレリンが新生ニューロンの移動に与える影響を調べるために、移動する新生ニューロンの培養液中にグレリンを添加しました。その結果、新生ニューロンの移動が促進したことから、グレリンには新生ニューロンに直接働きかけて移動を促進する作用があることが示されました。
次に、グレリンがどのようにして新生ニューロン移動を促進するのか、その仕組みを調べるために、細胞が移動する際に細胞内で収縮するアクチン骨格に着目しました。活性化アクチンのイメージングを行ったところ、グレリン添加によって新生ニューロンの細胞体後部においてアクチン骨格の収縮が活発になることが分かりました。このことから、血液から供給されたグレリンは、アクチン細胞骨格を制御することによって新生ニューロンの移動を促進することが示唆されました。
以上の結果より、新生ニューロンは血流の多い血管に沿って移動しやすく、その結果ニューロン再生は血流の豊富な場所で生じることが明らかとなりました。さらに、その効果の一部が空腹時に血液中で量の増加するグレリンによって担われることが示唆されました(下図B)。
血流の多い血管の近傍ほど新生ニューロンの移動速度が大きくなっていることから、血流が新生ニューロンの移動を促進していることが示唆されました。そこで、実際に新生ニューロンの移動が血流に依存するかどうかを調べるために、光血栓形成法(注4)を用いることによって、血管一本のレベルで血流を阻害する実験を行いました。移動中の新生ニューロンが沿っている血管の血流を阻害したところ、新生ニューロンの移動速度が低下したことから(下図A)、新生ニューロン移動が血流に依存していることが明らかとなりました。
以上のことから、血液中に何らかの移動促進因子が含まれている可能性が考えられました。本研究では、過去の報告を踏まえて、空腹時に胃で産生される末梢ホルモンであるグレリンに着目しました。蛍光標識したグレリンを血液中に投与し、脳内への輸送を調べたところ、血液由来グレリンの脳内輸送は血流の多い血管において盛んであることが分かりました。
グレリンが新生ニューロンの移動に与える影響を調べるために、移動する新生ニューロンの培養液中にグレリンを添加しました。その結果、新生ニューロンの移動が促進したことから、グレリンには新生ニューロンに直接働きかけて移動を促進する作用があることが示されました。
次に、グレリンがどのようにして新生ニューロン移動を促進するのか、その仕組みを調べるために、細胞が移動する際に細胞内で収縮するアクチン骨格に着目しました。活性化アクチンのイメージングを行ったところ、グレリン添加によって新生ニューロンの細胞体後部においてアクチン骨格の収縮が活発になることが分かりました。このことから、血液から供給されたグレリンは、アクチン細胞骨格を制御することによって新生ニューロンの移動を促進することが示唆されました。
以上の結果より、新生ニューロンは血流の多い血管に沿って移動しやすく、その結果ニューロン再生は血流の豊富な場所で生じることが明らかとなりました。さらに、その効果の一部が空腹時に血液中で量の増加するグレリンによって担われることが示唆されました(下図B)。
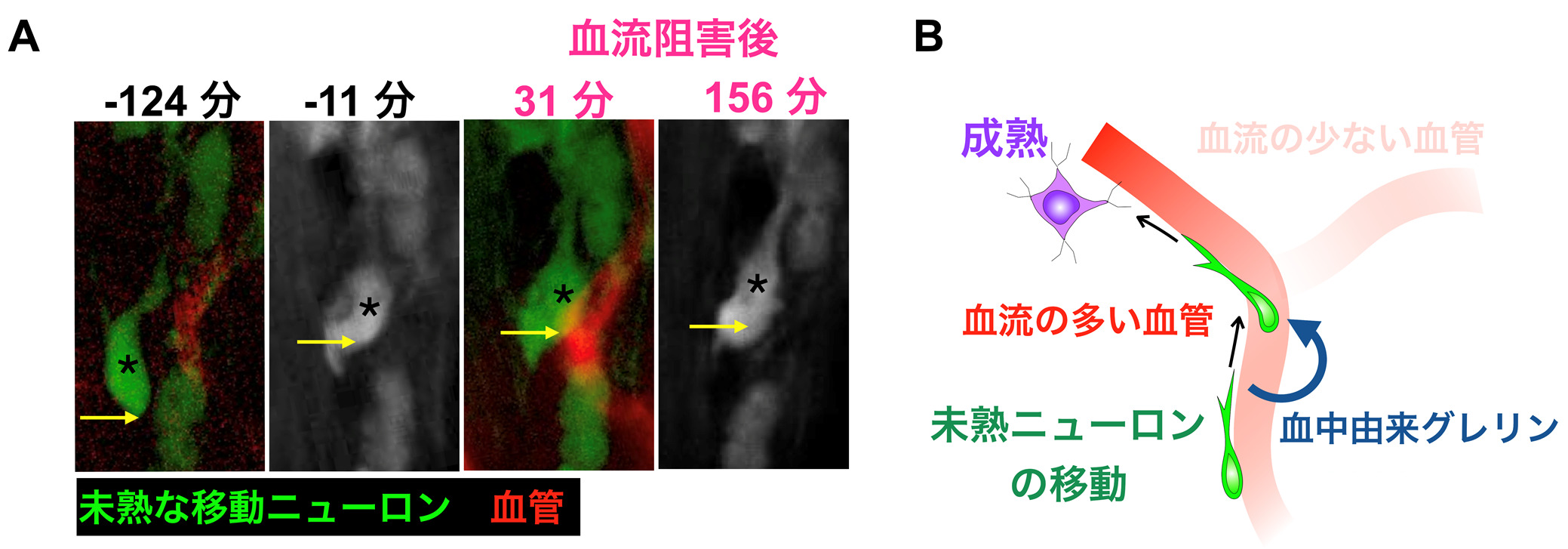
図:血流による新生ニューロン移動の制御
© 2025 Ogino et al., Originally published in eLife
DOI番号:https://doi.org/10.7554/eLife.99502.1
A. 光血栓形成法によって血流を停止させると、その血管(赤色)に沿って移動していた未熟な新生ニューロン(緑色、白色)の移動が阻害される。
B. 血流がニューロン再生を制御する仕組みの概要。
研究の意義と今後の展開や社会的意義など
私たちはこれまでに、新生ニューロンが血管に沿って移動するメカニズムについて研究してきました(Yamashita et al., J Neurosci, 2006; Kojima et al., Stem Cells, 2010; Fujioka et al., EBioMedicine, 2017)。その延長として行われた今回の研究により、血管を流れる血液の役割が初めて明らかとなりました。
成体脳におけるニューロン再生は、脳の限られた場所でしか生じない局所的なイベントですが、血流は全身をめぐることで、身体のさまざまな組織・器官の情報をそこへと伝達することができます。それとともに、血流は生物の生活環境をも反映しており、グレリンはマウスがエサの少ない飢餓状態に置かれると血液中で量が増加します。この仕組みにより、空腹下ではグレリンによる嗅球のニューロン再生が活発となり、その結果嗅覚機能が向上することで、マウスが飢餓環境下に適応するのに役立つ可能性があります。血流依存的なニューロン移動制御メカニズムは、局所的なニューロン再生が体全体の生理的状態、および外部の生活環境を感知し、それらに合わせて調整を受けるために意義のあるものと考えられます。
脳梗塞や脳損傷に伴うニューロンの欠損は、深刻な後遺症を引き起こすため、そのための治療法を開発することは医学的にも重要な課題として位置付けられています。傷害部で失われたニューロンを再生させることは、その戦略の一つですが、再生効率の高さは医療現場で適用するには十分ではありません。本研究で明らかとなった仕組みは、そのための治療的介入を行ううえで有効ではないかと期待されます。リハビリテーションや食事法の工夫によって、脳血流を促進させ、さらにニューロン再生に寄与する因子を脳傷害部に供給することで、効果的な治療が行えるようになる可能性があります。
成体脳におけるニューロン再生は、脳の限られた場所でしか生じない局所的なイベントですが、血流は全身をめぐることで、身体のさまざまな組織・器官の情報をそこへと伝達することができます。それとともに、血流は生物の生活環境をも反映しており、グレリンはマウスがエサの少ない飢餓状態に置かれると血液中で量が増加します。この仕組みにより、空腹下ではグレリンによる嗅球のニューロン再生が活発となり、その結果嗅覚機能が向上することで、マウスが飢餓環境下に適応するのに役立つ可能性があります。血流依存的なニューロン移動制御メカニズムは、局所的なニューロン再生が体全体の生理的状態、および外部の生活環境を感知し、それらに合わせて調整を受けるために意義のあるものと考えられます。
脳梗塞や脳損傷に伴うニューロンの欠損は、深刻な後遺症を引き起こすため、そのための治療法を開発することは医学的にも重要な課題として位置付けられています。傷害部で失われたニューロンを再生させることは、その戦略の一つですが、再生効率の高さは医療現場で適用するには十分ではありません。本研究で明らかとなった仕組みは、そのための治療的介入を行ううえで有効ではないかと期待されます。リハビリテーションや食事法の工夫によって、脳血流を促進させ、さらにニューロン再生に寄与する因子を脳傷害部に供給することで、効果的な治療が行えるようになる可能性があります。
用語解説
注1 新生ニューロン
成体マウスの脳室下帯に存在する神経幹細胞から産生される移動能を持つ未熟ニューロンである。嗅球へと移動した後、移動を停止して成熟ニューロンへと分化する。
注2 アクチン細胞骨格
アクチン分子が重合して形成される繊維状のタンパク質集合体であり、細胞内で動的に再編成されることで、細胞の形態変化や移動を制御する。
注3 二光子顕微鏡
通常の蛍光顕微鏡よりも長波長のレーザーを観察に用いることで、組織を通過することによる障害少なく深部までレーザー光を到達させることができる。観察対象で二光子励起を引き起こすことで、観察可能な蛍光を発する。
注4 光血栓形成法
血液中に光感受性色素ローズベンガルを投与し、特定の波長の光を照射すると、ローズベンガルが反応を起こして血管内に血栓が形成される。
成体マウスの脳室下帯に存在する神経幹細胞から産生される移動能を持つ未熟ニューロンである。嗅球へと移動した後、移動を停止して成熟ニューロンへと分化する。
注2 アクチン細胞骨格
アクチン分子が重合して形成される繊維状のタンパク質集合体であり、細胞内で動的に再編成されることで、細胞の形態変化や移動を制御する。
注3 二光子顕微鏡
通常の蛍光顕微鏡よりも長波長のレーザーを観察に用いることで、組織を通過することによる障害少なく深部までレーザー光を到達させることができる。観察対象で二光子励起を引き起こすことで、観察可能な蛍光を発する。
注4 光血栓形成法
血液中に光感受性色素ローズベンガルを投与し、特定の波長の光を照射すると、ローズベンガルが反応を起こして血管内に血栓が形成される。
研究助成
本研究は、日本医療研究開発機構(AMED)の革新的先端研究開発支援事業(AMED-CREST)「生体組織の適応・修復機構の時空間的解析による生命現象の理解と医療技術シーズの創出」研究開発領域における研究開発課題「ニューロン移動による傷害脳の適応・修復機構とその操作技術」(研究開発代表者:澤本和延)、独立行政法人日本学術振興会(JSPS)研究拠点形成事業-A 先端拠点形成型における研究課題「国際ニューロン新生研究拠点」などによる助成を受けて行われました。
論文情報
【論文タイトル】
Neuronal migration depends on blood flow in the adult brain
【著者】
荻野 崇1a、斎藤 明里1a、澤田 雅人1,2、竹村 晶子1、原 悠都樹1、吉村 奏美1、長瀬 次郎1、河瀬 穂乃美1、佐藤 誉将1、稲田 浩之3、Vicente Herranz-Pérez4, 5、向山 洋介6、依馬 正次7、José Manuel García-Verdugo4、鍋倉 淳一1, 3 、澤本 和延1, 2b
1: 名古屋市立大学大学院 医学研究科 脳神経科学研究所 神経発達・再生医学分野
2: 自然科学研究機構 生理学研究所 神経発達・再生機構研究部門
3: 自然科学研究機構 生理学研究所 生体恒常性発達研究部門
4: Laboratory of Comparative Neurobiology, Institute Cavanilles of Biodiversity and Evolutionary Biology, CIBERNED-ISCIII, University of Valencia
5: Department of Cell Biology, Functional Biology and Physical Anthropology, CIBERNED-ISCIII, University of Valencia
6: Laboratory of Stem Cell and Neuro-Vascular Biology, Cell and Development Biology Center, National Heart, Lung, and Blood Institute, National Institutes of Health, Bethesda, MD 20892, USA.
7: 滋賀医科大学 動物生命科学研究センター 幹細胞ヒト疾患モデル研究分野
a: 共同筆頭著者
b: 責任著者
【掲載学術誌】
学術誌名 : eLife
DOI番号:https://doi.org/10.7554/eLife.99502.1
Neuronal migration depends on blood flow in the adult brain
【著者】
荻野 崇1a、斎藤 明里1a、澤田 雅人1,2、竹村 晶子1、原 悠都樹1、吉村 奏美1、長瀬 次郎1、河瀬 穂乃美1、佐藤 誉将1、稲田 浩之3、Vicente Herranz-Pérez4, 5、向山 洋介6、依馬 正次7、José Manuel García-Verdugo4、鍋倉 淳一1, 3 、澤本 和延1, 2b
1: 名古屋市立大学大学院 医学研究科 脳神経科学研究所 神経発達・再生医学分野
2: 自然科学研究機構 生理学研究所 神経発達・再生機構研究部門
3: 自然科学研究機構 生理学研究所 生体恒常性発達研究部門
4: Laboratory of Comparative Neurobiology, Institute Cavanilles of Biodiversity and Evolutionary Biology, CIBERNED-ISCIII, University of Valencia
5: Department of Cell Biology, Functional Biology and Physical Anthropology, CIBERNED-ISCIII, University of Valencia
6: Laboratory of Stem Cell and Neuro-Vascular Biology, Cell and Development Biology Center, National Heart, Lung, and Blood Institute, National Institutes of Health, Bethesda, MD 20892, USA.
7: 滋賀医科大学 動物生命科学研究センター 幹細胞ヒト疾患モデル研究分野
a: 共同筆頭著者
b: 責任著者
【掲載学術誌】
学術誌名 : eLife
DOI番号:https://doi.org/10.7554/eLife.99502.1
