タウオパチーモデルマウスではCD8陽性T細胞の脳内での増加を介して神経変性を増悪させる~脳―免疫連関による認知症病態制御の一端を明らかに~
研究成果の概要
本研究は、名古屋市立大学大学院医学研究科 脳神経科学研究所 認知症科学分野 齊藤貴志 教授、上西涼平(同大学院生)、肱岡雅宣(同講師)、および熊本大学 生命資源研究・支援センター 動物資源開発研究施設(CARD)資源開発分野 竹尾透 教授らのグループによる共同研究の成果です。本共同研究グループは、多発性硬化症1)の治療薬として臨床応用されているフィンゴリモド (FTY720) 2)を認知症タウオパチーモデルマウスに投与すると、脳内のCD8陽性T細胞3)を増加させ、タウのリン酸化や脳の萎縮を促進させることを見いだしました。FTY720は本来、末梢血中のT細胞数を減少させ、脳内へのT細胞の侵入を抑制することで多発性硬化症の症状を抑制する効果が期待されます。しかし、タウオパチーモデルマウスでは、FTY720投与により末梢血中のT細胞数は減少するものの、脳内ではT細胞が増加するという予想に反した結果が示されました。
これらの結果は、脳内のCD8陽性T細胞の増加がタウ病態の進行に寄与しており、タウオパチーの発症機構において脳―免疫の相互作用が重要な役割を果たしていることを示唆しています。また、タウオパチーに対する新たな介入標的として、CD8陽性T細胞を制御することの重要性が見いだされました。
これらの結果は、脳内のCD8陽性T細胞の増加がタウ病態の進行に寄与しており、タウオパチーの発症機構において脳―免疫の相互作用が重要な役割を果たしていることを示唆しています。また、タウオパチーに対する新たな介入標的として、CD8陽性T細胞を制御することの重要性が見いだされました。
背景
タウオパチーとは、神経細胞の微小管結合タンパク質の一つであるタウが、リン酸化などの翻訳後修飾を受けることで、細胞内で蓄積・凝集し、その後、神経細胞が脱落することで認知機能の低下を招く神経変性疾患の総称です。タウオパチーの分類として、進行性核上性麻痺、大脳基底核変性症、ピック病、などが知られており、アルツハイマー病(AD)もタウオパチーの一種です。疾患により症状は異なりますが、認知機能障害や運動機能低下をもたらすため、患者や介護者の生活の質 (QOL) を低少させることが社会問題となっています。しかしながら、タウオパチーに対する有効な治療薬は未だ開発されていません。近年、免疫細胞であるT細胞が脳内にも存在していることが知られてきており、タウ病態の進行に関与することが示唆されています。そのため、脳内のT細胞の数や機能を制御することが、タウオパチーに対する新規治療法創出につながると期待されています。
そこで共同研究グループは、脳内のT細胞の数を減らすことを目的に、多発性硬化症の治療薬として臨床応用されているFTY720を、タウオパチーモデルであるP301S–Tau トランスジェニックマウス(Tau Tg マウス)4)に対して1ヶ月間連日投与することで、脳内のT細胞の数やその後のタウ病態におよぼす影響を検証しました。
そこで共同研究グループは、脳内のT細胞の数を減らすことを目的に、多発性硬化症の治療薬として臨床応用されているFTY720を、タウオパチーモデルであるP301S–Tau トランスジェニックマウス(Tau Tg マウス)4)に対して1ヶ月間連日投与することで、脳内のT細胞の数やその後のタウ病態におよぼす影響を検証しました。
研究の成果
はじめに、FTY720投与の効果を検証するため、末梢血中のT細胞の存在率をフローサイトメトリー5)にて解析しました。その結果、FTY720の薬効により、予想通り血中に存在するT細胞が顕著に減少していることが確認できました (図1)。
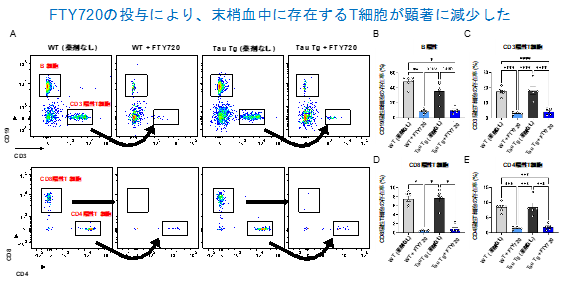
図1. (A–E) FTY720を投与した野生型マウス(WT)およびTau Tgマウスの末梢血中に存在する免疫細胞の展開図および存在率を確認した。 CD3陽性T細胞について、さらにCD4およびCD8に対する抗体を用いてCD4陽性およびCD8陽性T細胞を検出した。
次に研究グループは、T細胞の存在を視覚的に捉えるために免疫組織化学染色を行い、脳内T細胞数の定量を行いました。その結果、予想に反してFTY720投与により脳内のT細胞、特にCD8陽性T細胞は顕著に増加しました(図2)。
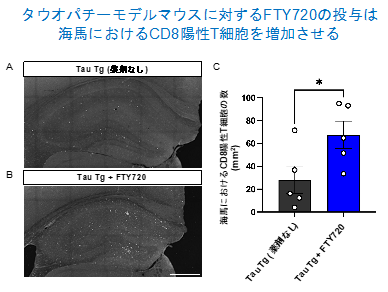
図2. (A–C) FTY720を投与したTau Tgマウスの海馬におけるCD8陽性T細胞の染色像およびCD8陽性T細胞の数の検証を行った。
サイズバー=500 µm
サイズバー=500 µm
さらに研究グループは、Tau Tgマウスにおけるタウ病態の悪性化の指標の一つであるタウのリン酸化や神経変性について検証を行いました。その結果、FTY720を投与したTau Tgマウスでは、リン酸化タウの量が増加する傾向を示し、脳内のCD8陽性T細胞の数とリン酸化タウの度合いには正の相関があること見出しました。また、FTY720の投与により、Tau Tgマウスにおける神経変性・脳萎縮が悪化することも見出しました(図3)。
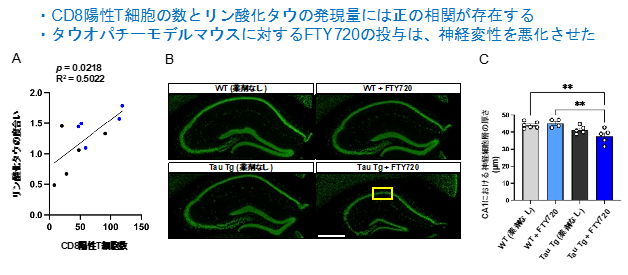
図3. (A) 海馬におけるCD8陽性T細胞の数とリン酸化タウの度合いで相関関係を検証したグラフ。青点: Tau Tg + FTY720, 黒点: Tau Tg (薬剤なし)。(B, C) 海馬における神経細胞の染色像およびCA1の神経細胞層の厚み。黄色い四角がCA1領域を示している。サイズバー = 500 µm。
これら一連の結果は、Tau Tgマウスにおいて、CD8陽性T細胞が脳内で増加することでタウ病態を増悪させる可能性を示しています。すなわち、脳内で増加するCD8陽性T細胞を標的にすることが、タウオパチーに対する有望な治療戦略となることを示唆しています。まだ、脳内でCD8陽性T細胞が増加するメカニズムは明らかになっていませんが、タウオパチーの発症に免疫細胞が関与する傍証を明らかにしました。一方、多発性硬化症患者へのFTY720の投薬により、脳内のT細胞が増加したケースも臨床報告されています。本研究は、多発性硬化症患者においてタウオパチーの素因を有する時に、FTY720の投与が脳内のT細胞を増加させ、臨床症状を悪化させる可能性も示しており、臨床的にも重要な意味を持つと考えられます。
研究のポイント
・タウオパチーモデルマウスへのFTY720の投与は、脳・海馬のCD8陽性T細胞数を増加させ、CD8陽性T細胞の数とリン酸化タウ発現量は正の相関を示した。
・タウオパチーモデルマウスへのFTY720の投与は、神経変性・脳萎縮を促進した。
・タウオパチーにおいて脳内のCD8陽性細胞の数を減らすことやCD8陽性細胞の機能を抑制することの重要性を示唆した。
・タウオパチーモデルマウスへのFTY720の投与は、神経変性・脳萎縮を促進した。
・タウオパチーにおいて脳内のCD8陽性細胞の数を減らすことやCD8陽性細胞の機能を抑制することの重要性を示唆した。
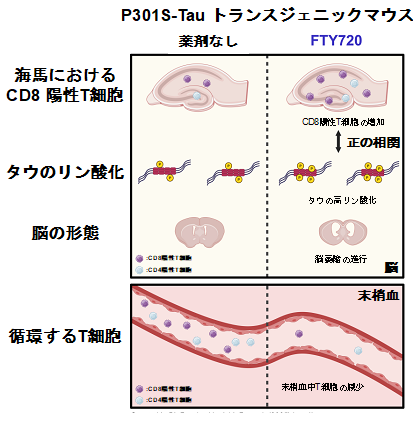
図4. 本研究内容をまとめた概略図
P301S-Tau トランスジェニックマウスにFTY720を投与すると、 末梢血中に存在するT細胞は激減する (図下段)。
一方、 FTY720を投与することにより、 脳内におけるT細胞、特にCD8陽性のT細胞は増加し、リン酸化タウの蓄積と正の相関をとることが判明した。さらに、脳萎縮の進行にも関与することを明らかにしている(図上段)。
P301S-Tau トランスジェニックマウスにFTY720を投与すると、 末梢血中に存在するT細胞は激減する (図下段)。
一方、 FTY720を投与することにより、 脳内におけるT細胞、特にCD8陽性のT細胞は増加し、リン酸化タウの蓄積と正の相関をとることが判明した。さらに、脳萎縮の進行にも関与することを明らかにしている(図上段)。
研究の意義と今後の展開や社会的意義など
近年、タウオパチーの進行過程において、脳内におけるT細胞の増加がタウ病態を促進するという仮説が提唱されています。本研究では、薬理学的アプローチを通じて、その仮説を支持する知見を得るとともに、特にCD8陽性T細胞の関与が重要であることを示しました。本成果は、現在有効な治療薬が存在しないタウオパチーに対して、新規治療薬の開発に資する重要な知見を提供するものです。
さらに、本研究は、タウオパチーの素因を有する多発性硬化症患者におけるFTY720の使用に対し、注意喚起するものでもあります。今後はタウオパチーの進行過程で脳内のT細胞が増加するメカニズムの解明を進めるとともに、その制御法を確立することで、新たな治療戦略の構築を目指していく必要があります。
さらに、本研究は、タウオパチーの素因を有する多発性硬化症患者におけるFTY720の使用に対し、注意喚起するものでもあります。今後はタウオパチーの進行過程で脳内のT細胞が増加するメカニズムの解明を進めるとともに、その制御法を確立することで、新たな治療戦略の構築を目指していく必要があります。
用語解説
1)多発性硬化症
脳や脊髄などの中枢神経系に障害が引き起こされる自己免疫疾患の一つ。症状としては運動機能障害や認知機能障害などが存在し、再発と寛解を繰り返すことが特徴として知られています。特に、免疫細胞であるT細胞が脳内で神経細胞障害を起こし病態の進行に深く関与していることが知られています。
2)フィンゴリモド (FTY720)
多発性硬化症の再発予防や身体的障害の進行抑制に用いられる免疫抑制剤。T細胞やB細胞などの免疫細胞表面に発現しているスフィンゴシン1-リン酸 (S1P) 受容体 (S1PR) と結合することで、S1PRの発現を低下させます。その結果、T細胞やB細胞などの免疫細胞を二次リンパ節に留めることで、末梢血中に移行できないようにする薬剤です。これにより、脳内へのT細胞の侵入を抑制することができます。
3) CD8陽性T細胞
ウイルスやがん細胞などの異物に感染した細胞を排除する免疫細胞として知られており、細胞傷害性T細胞(キラーT細胞)とも呼ばれています。
4) P301S–Tauトランスジェニックマウス(Tau Tg マウス)
家族性タウオパチーの一つであるFTDP-17 (17番染色体に連鎖する家族性前頭側頭型認知症パーキンソニズム) 患者から見出された遺伝子変異であるP301S変異を有するタウを過剰に発現させたタウオパチーモデルマウスです。これにより、リン酸化タウの蓄積、神経細胞の脱落などのタウ病理を呈するマウスです。
5) フローサイトメトリー
蛍光標識した細胞を流体中に分散させながら、様々なレーザー光を照射し、様々な検出器で蛍光を受け取り測定することで、特定の細胞がサンプル中にどのくらいの割合で存在するかを解析できる技術です。
脳や脊髄などの中枢神経系に障害が引き起こされる自己免疫疾患の一つ。症状としては運動機能障害や認知機能障害などが存在し、再発と寛解を繰り返すことが特徴として知られています。特に、免疫細胞であるT細胞が脳内で神経細胞障害を起こし病態の進行に深く関与していることが知られています。
2)フィンゴリモド (FTY720)
多発性硬化症の再発予防や身体的障害の進行抑制に用いられる免疫抑制剤。T細胞やB細胞などの免疫細胞表面に発現しているスフィンゴシン1-リン酸 (S1P) 受容体 (S1PR) と結合することで、S1PRの発現を低下させます。その結果、T細胞やB細胞などの免疫細胞を二次リンパ節に留めることで、末梢血中に移行できないようにする薬剤です。これにより、脳内へのT細胞の侵入を抑制することができます。
3) CD8陽性T細胞
ウイルスやがん細胞などの異物に感染した細胞を排除する免疫細胞として知られており、細胞傷害性T細胞(キラーT細胞)とも呼ばれています。
4) P301S–Tauトランスジェニックマウス(Tau Tg マウス)
家族性タウオパチーの一つであるFTDP-17 (17番染色体に連鎖する家族性前頭側頭型認知症パーキンソニズム) 患者から見出された遺伝子変異であるP301S変異を有するタウを過剰に発現させたタウオパチーモデルマウスです。これにより、リン酸化タウの蓄積、神経細胞の脱落などのタウ病理を呈するマウスです。
5) フローサイトメトリー
蛍光標識した細胞を流体中に分散させながら、様々なレーザー光を照射し、様々な検出器で蛍光を受け取り測定することで、特定の細胞がサンプル中にどのくらいの割合で存在するかを解析できる技術です。
研究支援・助成
【研究支援】
本研究は、名古屋市立大学 共同機器センター、 同 実験動物研究実験センター、熊本大学 生命資源研究・支援センター 動物資源開発研究施設(CARD)の支援を受けて行われました。
【研究助成】
本研究は、AMED (脳神経科学統合プログラムJP24wm0625303「タウオパチーにおけるグリア-末梢免疫連関および脳プロテオスタシス変容の理解と制御」、革新的先端研究開発支援事業JP20gm1210010「脳卒中・認知症の完全回復に向けた持続可能な神経回路の再構築を実現する治療開発」)、文部科学省・日本学術振興会科学研究費補助金(20H03564、JP24K02354、JP22K06865、JP24K18381、JP24KJ1888)、JST (ムーンショットJPMJMS2024 、SPRING Japan JPMJSP2130)、名古屋市立大学特別研究奨励費(2021101)、名古屋市立大学卓越研究グループ支援事業(2401101)、東京科学大学難治疾患共同研究拠点活動(Grant No. 2025-kokunai 29)、堀科学芸術振興財団助成、豊秋奨学会助成等を受けて行われました。
本研究は、名古屋市立大学 共同機器センター、 同 実験動物研究実験センター、熊本大学 生命資源研究・支援センター 動物資源開発研究施設(CARD)の支援を受けて行われました。
【研究助成】
本研究は、AMED (脳神経科学統合プログラムJP24wm0625303「タウオパチーにおけるグリア-末梢免疫連関および脳プロテオスタシス変容の理解と制御」、革新的先端研究開発支援事業JP20gm1210010「脳卒中・認知症の完全回復に向けた持続可能な神経回路の再構築を実現する治療開発」)、文部科学省・日本学術振興会科学研究費補助金(20H03564、JP24K02354、JP22K06865、JP24K18381、JP24KJ1888)、JST (ムーンショットJPMJMS2024 、SPRING Japan JPMJSP2130)、名古屋市立大学特別研究奨励費(2021101)、名古屋市立大学卓越研究グループ支援事業(2401101)、東京科学大学難治疾患共同研究拠点活動(Grant No. 2025-kokunai 29)、堀科学芸術振興財団助成、豊秋奨学会助成等を受けて行われました。
論文情報
【論文タイトル】
Fingolimod treatment exacerbates tau phosphorylation and neurodegeneration in a mouse model of tauopathy with accumulated brain CD8+ T cells
【掲載学術誌】
学術誌名 Brain Communications
DOI番号:https://academic.oup.com/braincomms/article-lookup/doi/10.1093/braincomms/fcaf330
Fingolimod treatment exacerbates tau phosphorylation and neurodegeneration in a mouse model of tauopathy with accumulated brain CD8+ T cells
【掲載学術誌】
学術誌名 Brain Communications
DOI番号:https://academic.oup.com/braincomms/article-lookup/doi/10.1093/braincomms/fcaf330
