出生後に突起切断し血管に接着 脳の幹細胞維持の仕組み解明
研究成果の概要
さらに、早産ではこの変換プロセスが阻害され、成体神経幹細胞の形態異常が長期にわたり持続することから、この変換が神経幹細胞としての性質を保つために重要であることが示唆されました。
本研究は、「生まれる」という出来事が幹細胞自身の構造と性質に長期的な影響を与えることを示すもので、脳の発達や早産に伴う神経障害の新たな理解につながる可能性があります。
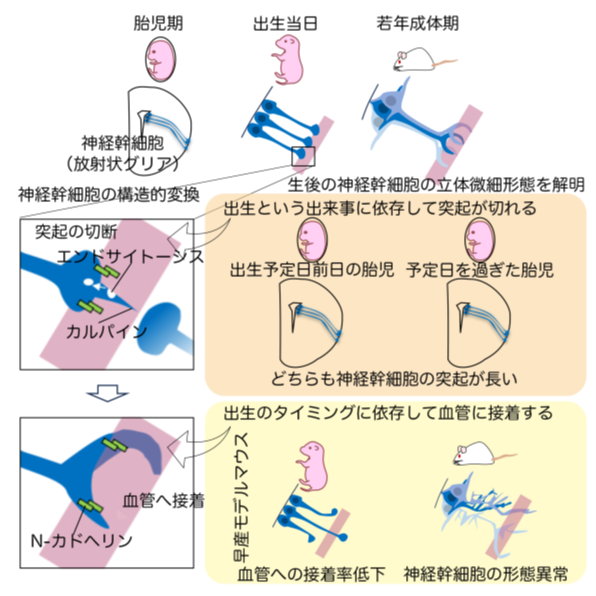
図1:本研究成果の概要
© 2025 Takemura et al., Originally published in Cell Reports
DOI番号:https://doi.org/10.1016/j.celrep.2025.116029
研究のポイント
・生後の神経幹細胞が血管に接着して静止状態を維持していることは知られていましたが、本研究ではこの接着が出生当日に起こることを初めて明らかにしました。
・最先端の3次元電子顕微鏡技術(注2)とシングルセル遺伝子発現解析(注3)を用いて、脳室下帯における構造や遺伝子発現パターン、さらに早産の影響を明らかにしました。
背景
その一つである脳室下帯では、胎児期の神経幹細胞が長い突起を持つ一方、生後の神経幹細胞は短い突起を血管に接着しており、この接着が静止状態の維持に重要とされています。しかし、胎児期から生後の神経幹細胞へのこの構造的な変換がいつどのように起きるのかはこれまで明らかになっていませんでした。
私たちはこの研究で、出生という大きな環境変化、すなわち子宮という水中から大気中へ移行することが、この神経幹細胞の構造的な変換を引き起こすスイッチになっているのではないか、という仮説を立てました。水中生活のゼブラフィッシュでは成体でも突起の長い神経幹細胞が存在することから着想を得て、この仮説を検証しました。
研究の成果
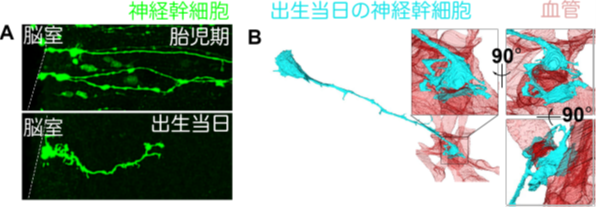
図2:出生当日の神経幹細胞の構造的変換
© 2025 Takemura et al., Originally published in Cell Reports
DOI番号:https://doi.org/10.1016/j.celrep.2025.116029
A. 胎児期には神経幹細胞(緑色)の長い突起が出生当日に短くなる。
B. 出生当日の神経幹細胞(青色)が血管(赤色)に接着する様子。3次元電子顕微鏡観察により直接接着していることが明らかとなった。3次元電子顕微鏡観察では、いろいろな角度から神経幹細胞と血管の関係を観察することができる。
一方で早産モデルマウスでは、出生当日の神経幹細胞の突起の短縮は認められますが、血管への接着が不十分でした。成体になっても神経幹細胞に構造異常が持続していることが、3次元電子顕微鏡解析やシングルセル解析により明らかになりました(図3AおよびB)。ヒト剖検脳でも、正期産児では新生ニューロンが神経幹細胞と思われるグリア細胞にトンネル状に囲まれているのに対し、早産児ではこの構造に乱れが生じていました(図3CおよびD)。
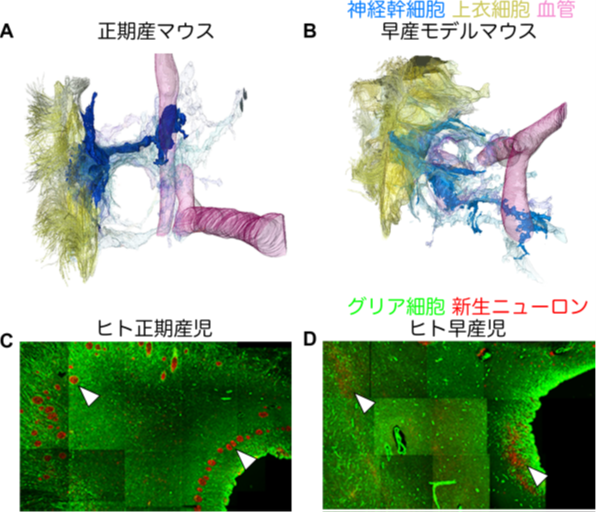
図3:早産によって乱れる脳室下帯の構造
© 2025 Takemura et al., Originally published in Cell Reports
DOI番号:https://doi.org/10.1016/j.celrep.2025.116029
A. 成体の正期産マウスでは神経幹細胞(青色)は上衣細胞(黄色)が存在する脳室付近から突起を伸ばして血管(ピンク色)へ接着した。一方、早産モデルマウスでは神経幹細胞の突起は分岐を多数持ち、血管への接着も損なっていた。
B. ヒト正期産乳児の脳室下帯では、新生ニューロン(赤色、例を矢がしらで示す)が神経幹細胞と思われるグリア細胞(緑色)にトンネル状に囲まれているのに対し、早産児ではこの構造が乱れて新生ニューロンが散在した。
以上の結果から、神経幹細胞は出生したその日に突起を切断し血管に接着することで、生後の神経幹細胞構造へと変換することが明らかになりました。本研究は、「生まれる」という出来事が幹細胞の構造と性質に長期的な影響を与えることを示し、神経発達や早産に伴う障害の理解に新たな視点を提供するものです。
研究の意義と今後の展開や社会的意義など
本研究は、「出生」という出来事とそのタイミングが、神経幹細胞の構造や機能に影響を与えることを示しました。これは、出生が単なる時間経過ではなく、発生過程における重要なトリガーである可能性を示しています。今後は酸素分圧の上昇に加え、体温、栄養、ホルモン、機械的刺激など、さまざまな環境要因が幹細胞の維持や全身の発達に与える影響を明らかにし、発達の仕組みのさらなる解明につなげることが期待されます。
用語解説
自己複製能と多分化能とを持つ細胞である。成体マウスでは海馬や脳室下帯に存在する。
注2 3次元電子顕微鏡
細胞や組織の立体構造を高解像度可視化する技術。本研究に用いたSerial block-face scanning electron microscopy(SBF-SEM, 連続ブロック表面走査型電子顕微鏡)法では、連続切片を電子顕微鏡観察し、細胞ごとに色を塗り分けて立体像を再構築する。
注3 シングルセル遺伝子発現解析
個々の細胞ごとの遺伝子転写産物(メッセンジャーRNA)の発現状態を網羅的に解析する技術である。
注4 N-カドヘリン
細胞間接着を担う膜貫通タンパク質である。
研究助成
論文情報
Transformation of radial glia into postnatal neural stem cells depends on birth
【著者】
竹村晶子1,2,3,4a, 川瀬恒哉1,5a, Laura Wolbeck6a, 中村泰久1,5,7a, 松本真実1,2, 神農英雄1,5,8, 田原愛香1, 澤田雅人1,2, 久保田義顕9, Vicente Herranz-Pérez10,11, José Manuel García-Verdugo10, Nobuyuki Ishibashi8,12, Vittorio Gallo8,13, 大野伸彦14,15, Konstantin Khodosevich6, 澤本和延1,2b
1: 名古屋市立大学大学院 医学研究科 脳神経科学研究所 神経発達・再生医学分野
2: 自然科学研究機構 生理学研究所 神経発達・再生機構研究部門
3: 藤田医科大学 医学部 発生学講座
4: 藤田医科大学 精神‧神経病態解明センター 神経発生学部門
5: 名古屋市立大学大学院 医学研究科 新生児・小児医学分野
6: Biotech Research & Innovation Centre (BRIC), Faculty of Health and Medical Sciences, University of Copenhagen
7: 名古屋市立大学医学部附属 西部医療センター 小児科
8: Center for Neuroscience Research, Children’s National Research Institute, Children’s National Hospital
9: 慶應義塾大学 医学部 解剖学教室
10: Laboratory of Comparative Neurobiology, Institute Cavanilles of Biodiversity and Evolutionary Biology, CIBERNED-ISCIII, University of Valencia
11: Department of Cell Biology, Functional Biology and Physical Anthropology, CIBERNED-ISCIII, University of Valencia
12: Department of Anatomy and Neurobiology, Boston University Chobanian and Avedisian School of Medicine
13: Seattle Children’s Research Institute, Seattle Children’s Hospital
14: 自然科学研究機構 生理学研究所 超微形態研究部門
15: 自治医科大学 医学部解剖学講座組織学部門
a: 共同筆頭著者
b: 責任著者
【掲載学術誌】
学術誌名 : Cell Reports
DOI番号:https://doi.org/10.1016/j.celrep.2025.116029
