ありふれたウイルスががんを引き起こす機構を解明!
研究成果の概要
EBウイルスEBVは世界中のほとんどの人に生涯潜伏感染しているありふれたウイルスですが、ごく一部の感染者には 様々ながんを引き起こします。本研究では、世界中の人から取得したEBVのゲノムを解析し、このウイルスが特定の人にだけがんを発症させる仕組みや、1種類のウイルスが 20種類以上のがんに関わる仕組みなどを解明しました。本成果は、EBVが引き起こすがんの予防や治療法開発に役立ちます。
研究のポイント
・EBVが特定の人だけにがんを起こす仕組みを明らかにしました。
・たった1種類のウイルスが多様ながんを発生させる理由を解明しました。
・このウイルスががんを起こす仕組みの理解が深まり、予防・治療法開発に貢献します。
・たった1種類のウイルスが多様ながんを発生させる理由を解明しました。
・このウイルスががんを起こす仕組みの理解が深まり、予防・治療法開発に貢献します。
背景
名古屋市立大学大学院医学研究科ウイルス学分野の奥野友介(おくの ゆうすけ)教授、濱田太立(はまだ もとはる)講師、名古屋大学大学院医学系研究科ウイルス学の木村宏(きむら ひろし)教授、佐藤好隆(さとう よしたか)准教授らの国際共同研究グループは、世界各地から集めたEBVの遺伝情報(ゲノム)を解析し、このウイルスががんを引き起こす新たな仕組みを解明しました。本研究成果は、米国血液学会の科学誌『Blood』に掲載されます(米国時間2025年6月26日付の電子版)。
EBVは、世界人口の約95%が成人までに感染するウイルスで、感染時に風邪のような軽い症状を起こした後に、生涯にわたり体内に潜伏し続けます。潜伏感染している人の多くには害を与えませんが、一部の人に対してはさまざまながんを引き起こすことが知られています。また、他のがんに関連するウイルスが起こすがんは1~数種類に限られるのに対し、EBVは20種類を超えるがんに関連します。しかし、なぜEBVがこれらの特徴を持つのかは明らかではありませんでした。
EBVは、世界人口の約95%が成人までに感染するウイルスで、感染時に風邪のような軽い症状を起こした後に、生涯にわたり体内に潜伏し続けます。潜伏感染している人の多くには害を与えませんが、一部の人に対してはさまざまながんを引き起こすことが知られています。また、他のがんに関連するウイルスが起こすがんは1~数種類に限られるのに対し、EBVは20種類を超えるがんに関連します。しかし、なぜEBVがこれらの特徴を持つのかは明らかではありませんでした。
研究の成果
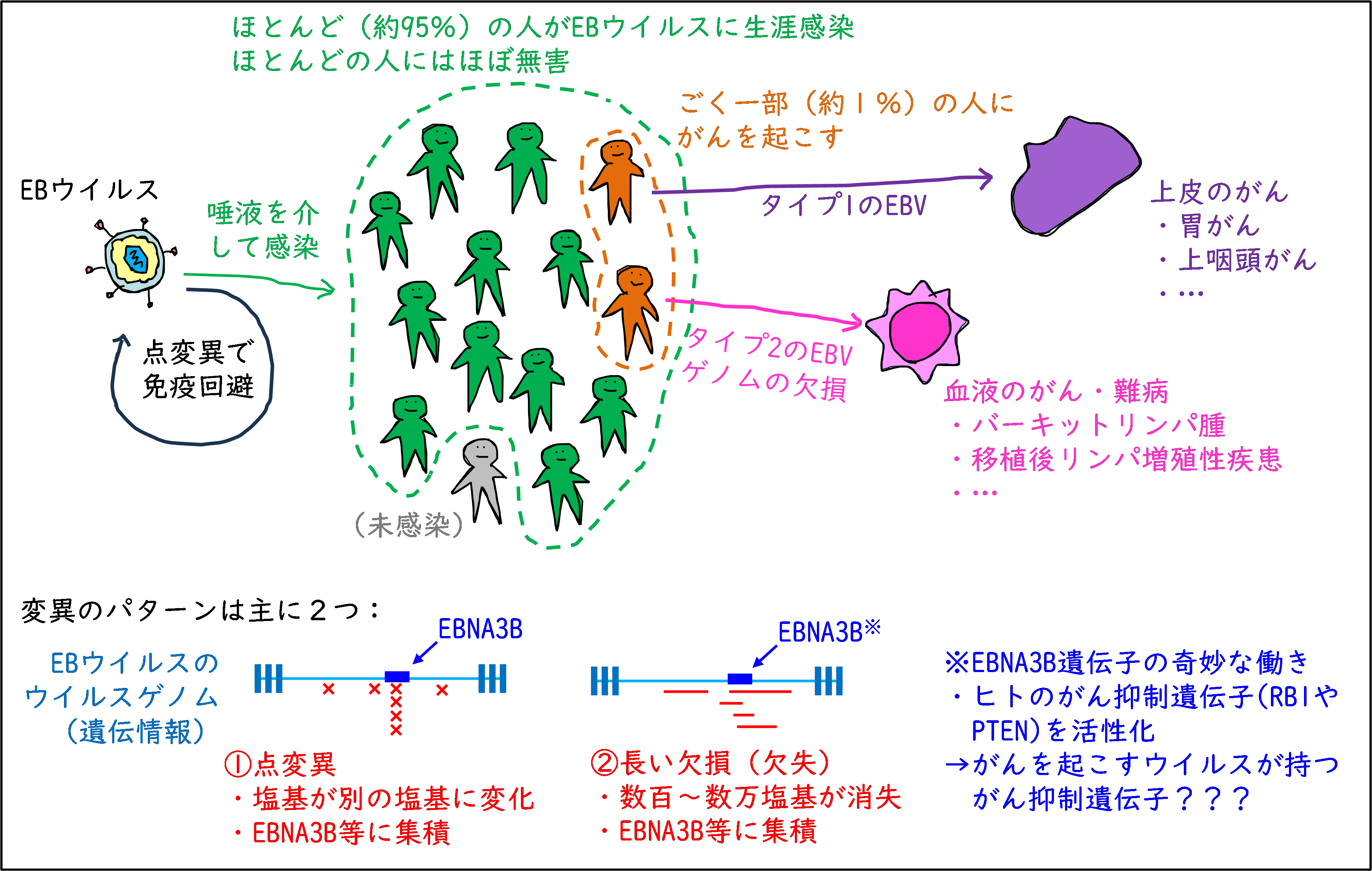
図1.今回の研究で判明した、EBウイルスが様々ながんを引き起こすための仕組み
本研究グループは、EBVががんを引き起こす仕組みを明らかにするため、世界中から収集した計990株のEBVウイルスの遺伝情報(ゲノム)を次世代シーケンサーで解析しました。
ウイルスの系統解析をしたところ、EBVは地域ごとに若干異なる塩基配列を有しており、地域ごとに少し異なる進化を遂げていることがわかりました。また、EBVは大きくタイプ1とタイプ2という系統に分かれるのですが、この2つの系統の割合が病気ごとに異なることが判明しました。特に、胃がんにおいてはタイプ1がほぼ100%を占めており、B細胞(リンパ球の一種。免疫系の、抗体を作る細胞)が起こす病気ではタイプ2の割合が高いことが特徴的でした。すなわち、EBVの遺伝情報が違うと、起こる病気が変わることがわかりました。
さらに詳細に見ていくと、日本のEBVにおいて、EBNA3Bというウイルスの遺伝子に、繰り返し変異が生じていることが判明しました。これは、ヒトがEBVを排除しようとする免疫応答においてEBNA3B遺伝子が重要な標的になっている可能性を示します。これは今回の遺伝子解析研究で初めて判明したことですが、培養細胞を用いた追加の実験でもこの可能性を検証することができました。
本研究グループは以前、がん細胞から抽出したEBVのゲノムは、最大で4割ほどの長さの領域が欠損しており、それががん化の原因となることを報告しています。今回の研究では、欠損は血液のがんでは高頻度に見られますが、胃がんや上咽頭がんといった血液以外のがんではほぼ見られませんでした。これは、EBVゲノムが欠損すると、血液がんを発生させやすいことを示しています。言い換えると、EBVががんを起こす際に、血液がんとそれ以外のがんでは異なる仕組みを用いることがわかりました。
EBVゲノムの欠損は、株ごとに(患者ごとに)欠損する領域が異なっていましたが、特に欠損が集中するウイルス遺伝子として、EBNA3B遺伝子が見つかりました。がんにおいて欠損が集中するヒトの遺伝子は、がんの発生を抑える働きを有しており(がん抑制遺伝子)、TP53遺伝子、BRCA2遺伝子などがその代表です。EBNA3B遺伝子に欠損が集中するということは、この遺伝子はがんを起こすウイルスが持つ遺伝子であるにも関わらず、がんを抑制する遺伝子であるという、少し奇妙なことを示しています。奇妙ではありますが、この観察に基づいて培養細胞で実験を行い、EBNA3B遺伝子が人のがん抑制遺伝子(特にPTEN遺伝子とRB1遺伝子)の働きを活性化することを見出しました。がんを起こすウイルス自身ががん抑制遺伝子を持つ理由、あるいはがんを起こすウイルス自身が人のがん抑制遺伝子を活性化させる理由については未だ不明ですが、今後の研究における興味深い研究課題と考えられます。
ウイルスの系統解析をしたところ、EBVは地域ごとに若干異なる塩基配列を有しており、地域ごとに少し異なる進化を遂げていることがわかりました。また、EBVは大きくタイプ1とタイプ2という系統に分かれるのですが、この2つの系統の割合が病気ごとに異なることが判明しました。特に、胃がんにおいてはタイプ1がほぼ100%を占めており、B細胞(リンパ球の一種。免疫系の、抗体を作る細胞)が起こす病気ではタイプ2の割合が高いことが特徴的でした。すなわち、EBVの遺伝情報が違うと、起こる病気が変わることがわかりました。
さらに詳細に見ていくと、日本のEBVにおいて、EBNA3Bというウイルスの遺伝子に、繰り返し変異が生じていることが判明しました。これは、ヒトがEBVを排除しようとする免疫応答においてEBNA3B遺伝子が重要な標的になっている可能性を示します。これは今回の遺伝子解析研究で初めて判明したことですが、培養細胞を用いた追加の実験でもこの可能性を検証することができました。
本研究グループは以前、がん細胞から抽出したEBVのゲノムは、最大で4割ほどの長さの領域が欠損しており、それががん化の原因となることを報告しています。今回の研究では、欠損は血液のがんでは高頻度に見られますが、胃がんや上咽頭がんといった血液以外のがんではほぼ見られませんでした。これは、EBVゲノムが欠損すると、血液がんを発生させやすいことを示しています。言い換えると、EBVががんを起こす際に、血液がんとそれ以外のがんでは異なる仕組みを用いることがわかりました。
EBVゲノムの欠損は、株ごとに(患者ごとに)欠損する領域が異なっていましたが、特に欠損が集中するウイルス遺伝子として、EBNA3B遺伝子が見つかりました。がんにおいて欠損が集中するヒトの遺伝子は、がんの発生を抑える働きを有しており(がん抑制遺伝子)、TP53遺伝子、BRCA2遺伝子などがその代表です。EBNA3B遺伝子に欠損が集中するということは、この遺伝子はがんを起こすウイルスが持つ遺伝子であるにも関わらず、がんを抑制する遺伝子であるという、少し奇妙なことを示しています。奇妙ではありますが、この観察に基づいて培養細胞で実験を行い、EBNA3B遺伝子が人のがん抑制遺伝子(特にPTEN遺伝子とRB1遺伝子)の働きを活性化することを見出しました。がんを起こすウイルス自身ががん抑制遺伝子を持つ理由、あるいはがんを起こすウイルス自身が人のがん抑制遺伝子を活性化させる理由については未だ不明ですが、今後の研究における興味深い研究課題と考えられます。
研究の意義と今後の展開や社会的意義など
今回の研究成果は、大規模なウイルスゲノムの解析によって、EBVのゲノムに生じる変異ががん化の原因となることを明らかにしました。この変異は非常に稀であるため、EBVが大半の人に感染しているにも関わらず、一部の人にのみがんを引き起こす理由の一つと考えられます。また、EBVのタイプや変異は特定のがんと関連していました。言い換えると、EBVはがんを生じさせる複数の仕組みを備えており、それがこのウイルスが多くの種類のがんと関連する理由の一つと考えられます。
今回の研究は、EBVががんを発生させる様々な機構を新たに解明したものです。EBNA3Bを標的とした免疫療法は、EBVの制御に役立つ新たな治療法となる可能性があります。それ以外の発見は、すぐに治療法に結び付くものではありませんが、それにたどり着くための重要な基盤を構築できたものと考えています。
今回の研究は、EBVががんを発生させる様々な機構を新たに解明したものです。EBNA3Bを標的とした免疫療法は、EBVの制御に役立つ新たな治療法となる可能性があります。それ以外の発見は、すぐに治療法に結び付くものではありませんが、それにたどり着くための重要な基盤を構築できたものと考えています。
用語解説
EBウイルス(EBV):エプスタイン・バーウイルスの略称。感染した人に風邪、あるいは伝染性単核球症(2週間以上にわたって発熱等の症状が持続する感染症)などを引き起こす。一部の人にはがんを発生させる。慢性活動性EBV病や多発性硬化症といった難病にも関与する。
ゲノム:生物やウイルスの遺伝情報。4種類の塩基が連なって構成される。生物のゲノムはデオキシリボ核酸(DNA)からなるが、一部のウイルスのリボ核酸(RNA)をゲノムとして用いる。
次世代シーケンサー:大量の塩基配列を高速で解析する最新の装置。ヒトやウイルスのゲノムを端から端まで解読することを可能にした。
EBNA3B遺伝子:EBVが持つ80個ほどの遺伝子の一つ。その機能は明らかになっていなかった。
潜伏感染:ウイルスが体内に存在し続ける状態。EBVの場合は、ごく少数のB細胞に、生涯にわたって潜伏感染する。
ゲノム:生物やウイルスの遺伝情報。4種類の塩基が連なって構成される。生物のゲノムはデオキシリボ核酸(DNA)からなるが、一部のウイルスのリボ核酸(RNA)をゲノムとして用いる。
次世代シーケンサー:大量の塩基配列を高速で解析する最新の装置。ヒトやウイルスのゲノムを端から端まで解読することを可能にした。
EBNA3B遺伝子:EBVが持つ80個ほどの遺伝子の一つ。その機能は明らかになっていなかった。
潜伏感染:ウイルスが体内に存在し続ける状態。EBVの場合は、ごく少数のB細胞に、生涯にわたって潜伏感染する。
研究助成
本研究は、文部科学省の科学研究費(JP22H02878)、日本医療研究開発機構(AMED)の開発研究費(JP19ck0106517「Epstein-Barrウイルス感染がん治療薬の開発」)、ならびに武田科学振興財団、公益財団法人 大幸財団、名古屋小児がん基金からの助成金によって実施されました。
論文タイトル
Association of Epstein–Barr viral genomic alterations to human pathologies
- EBV genomic variations contribute to human cancers -
(EBウイルスのゲノム変異とヒト疾患の関連性:ウイルスゲノムの変異がヒトのがんに関与する)
- EBV genomic variations contribute to human cancers -
(EBウイルスのゲノム変異とヒト疾患の関連性:ウイルスゲノムの変異がヒトのがんに関与する)
著者
Htet Thiri Khine1, Yoshitaka Sato2, Motoharu Hamada1, Miki Umeda2, Akira Iizuka3, Shika Son1, Haruto Arai1, Yuki Kojima4, Takahiro Watanabe2,5,6, Azumi Naruse1, Kimitoshi Goto1, Koichi Ohshima7, Yuta Akutsu1, Masato Nakaguro8, Akira Satou8, Hiromi Kataoka4, Yoshinori Ito9, Akihisa Sawada10, Seiichi Kato11, Jun-ichi Kawada12, Takayuki Murata13, Yusuke Okuno1,*, and Hiroshi Kimura2,*
(*Corresponding author)
所属
1:Department of Virology, Nagoya City University Graduate School of Medical Sciences, Nagoya, Japan
2:Department of Virology, Nagoya University Graduate School of Medicine, Nagoya, Japan
3:Immunotherapy Division, Shizuoka Cancer Center Research Institute, Shizuoka, Japan
4:Department of Gastroenterology and Metabolism, Nagoya City University Graduate School of Medical Sciences, Nagoya, Japan
5:Section on Pathophysiology and Molecular Pharmacology, Joslin Diabetes Center, Boston, MA, USA
6:Department of Microbiology, Harvard Medical School, Boston, MA, USA
7:Department of Pathology, Kurume University School of Medicine, Kurume, Japan
8:Department of Pathology and Laboratory Medicine, Nagoya University Hospital, Nagoya, Japan
9:Department of Pediatrics, Aichi Medical University, Nagakute, Japan
10:Department of Hematology/Oncology, Osaka Women’s and Children’s Hospital, Osaka, Japan
11:Department of Pathology and Microbiology, Faculty of Medicine, Saga University, Saga, Japan
12:Department of Pediatrics, Fujita Health University, Toyoake, Japan
13:Department of Virology, Fujita Health University, Toyoake, Japan
(*Corresponding author)
所属
1:Department of Virology, Nagoya City University Graduate School of Medical Sciences, Nagoya, Japan
2:Department of Virology, Nagoya University Graduate School of Medicine, Nagoya, Japan
3:Immunotherapy Division, Shizuoka Cancer Center Research Institute, Shizuoka, Japan
4:Department of Gastroenterology and Metabolism, Nagoya City University Graduate School of Medical Sciences, Nagoya, Japan
5:Section on Pathophysiology and Molecular Pharmacology, Joslin Diabetes Center, Boston, MA, USA
6:Department of Microbiology, Harvard Medical School, Boston, MA, USA
7:Department of Pathology, Kurume University School of Medicine, Kurume, Japan
8:Department of Pathology and Laboratory Medicine, Nagoya University Hospital, Nagoya, Japan
9:Department of Pediatrics, Aichi Medical University, Nagakute, Japan
10:Department of Hematology/Oncology, Osaka Women’s and Children’s Hospital, Osaka, Japan
11:Department of Pathology and Microbiology, Faculty of Medicine, Saga University, Saga, Japan
12:Department of Pediatrics, Fujita Health University, Toyoake, Japan
13:Department of Virology, Fujita Health University, Toyoake, Japan
掲載学術誌
Blood(米国血液学会の学会誌)
DOI番号: 10.1182/blood.2024028055
DOI番号: 10.1182/blood.2024028055
